近日,我所翁长江团队在天然免疫研究上取得新进展,相关研究成果以“DDX19 inhibits type I interferon production by disrupting TBK1-IKKε-IRF3 interactions and promoting TBK1 and IKKε degradation”为题于1月29日在线发表《Cell Reports》上。该研究发现DExD/H-box解旋酶家族成员DDX19分子是RIG-I样受体(RLRs)介导Ⅰ型干扰素产生的负调控分子,阐明了DDX19抑制Ⅰ型干扰素产生的两种作用机制。这是该团队在发现DDX19作为病毒RNA受体参与NLRP3炎症反应之后取得的又一重要研究进展。
天然免疫反应(innate immune response)是宿主通过识别“自我”与“非我”,抵抗病原微生物入侵的第一道防线。其中,RLRs信号通路是机体识别病毒感染、抑制及清除病毒的重要信号通路。DExD/H-box解旋酶家族成员RIG-I (DDX58)、MDA5、LGP-2 (DHX58)等在RLRs信号通路调控中发挥重要作用。
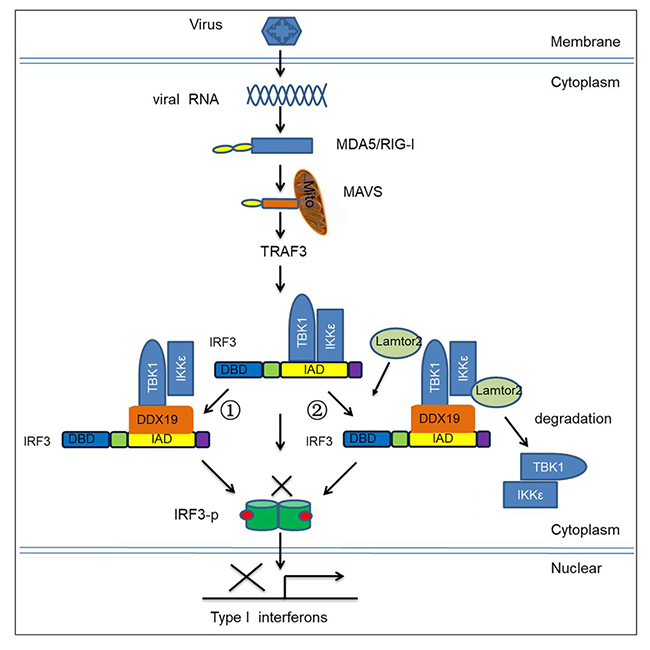
本研究中,科研人员分别在传代细胞系、DDX19过表达稳定细胞株、DDX19基因敲除细胞株和DDX19基因敲除小鼠上证明了DDX19是RLRs信号通路的负调节分子。深入研究发现,DDX19通过破坏TBK1-IKKε-IRF3复合物形成,抑制IRF3的磷酸化,并招募Lamtor2蛋白,促进TBK1和IKKε的降解,最终抑制Ⅰ型干扰素的产生。
本研究是在国家自然科学基金项目(31640083和31300139)的资助下完成的。博士研究生张昆丽和硕士研究生张元峰为论文共同第一作者,黄丽副研究员和翁长江研究员为共同通讯作者。(张昆丽 黄丽)
SUMMARY
DExD/H-box helicase members are key receptors for recognizing viral nucleic acids and they regulate RLR-mediated type I interferon (IFN) production. Here we report that the DExD/H-box helicase family member DDX19 is a negative regulator of type I IFN production. Ectopic expression of DDX19 suppressed poly(I:C)- and Sendai virus-induced type I IFN production, whereas knockdown of DDX19 expression enhanced type I IFN production. Mechanistically, DDX19 inhibited TBK1- and IKKε-mediated phosphorylation of IRF3 by disrupting the interaction between TBK1 or IKKε and IRF3. Additionally, DDX19 recruited Lamtor2 and then formed the TBK1-IKKε-Lamtor2-DDX19-IRF3 complex to suppress IFN production by promoting TBK1 and IKKε degradation. We generated Ddx19 knockout mice using TALENs and found that Ddx19 deficiency in vivo augmented type I IFN production, resulting in suppression of encephalomyocarditis virus replication. These data show that DDX19 is an important negative regulator of RLR-mediated type I IFN production.