近日,中国农业科学院哈尔滨兽医研究所冯力研究员领衔的猪消化道传染病创新团队在内质网应激(ER stress)调控猪传染性胃肠炎病毒感染的研究中取得新进展,相关研究成果以“The PERK Arm of the Unfolded Protein Response Negatively Regulates Transmissible Gastroenteritis Virus Replication by Suppressing Protein Translation and Promoting Type I IFN Production”为题,发表在病毒学专业期刊《病毒学杂志(Journal of Virology)》上。该研究阐明了内质网应激抑制TGEV复制的分子机制,为研发抗冠状病毒药物靶点和制定抗病毒新策略提供了重要理论依据。
猪传染性胃肠炎病毒(Transmissible Gastroenteritis Virus,TGEV)属于α冠状病毒,能引起猪呕吐、脱水和严重腹泻等症状,2周龄内的仔猪死亡率可达 90%-100%。TGEV是引起规模化养猪场新生仔猪腹泻性死亡的重要原因,给我国养猪业造成了严重的经济损失。
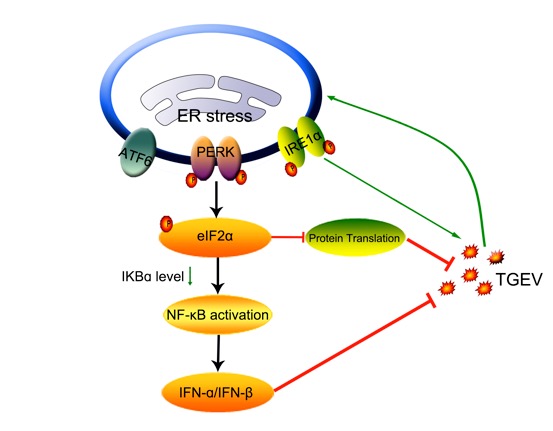
内质网作为蛋白质折叠和翻译后修饰的重要场所,是病毒复制和成熟的必需细胞器。病毒感染后,细胞内合成大量的病毒蛋白,从而增加内质网的负担,进而增加了未折叠蛋白和错误折叠蛋白的堆积。因此,病毒感染后通常会诱发内质网应激。但是,对于内质网应激如何调控冠状病毒的复制及其调控机制目前还不明确。在刘平黄研究员的指导下,该团队薛美博士发现TGEV感染在体内和体外均能诱导内质网应激,激活未折叠蛋白反应,进一步研究发现TGEV诱导的内质网应激负调控病毒复制。尽管TGEV感染能够不同程度的激活PERK、ATF6和IRE1三个信号通路,利用RNA干扰和特异性抑制剂处理发现仅PERK通路发挥抑制TGEV复制的功能。其分子机制是PERK通路激活导致eIF2α磷酸化,磷酸化的eIF2α通过抑制蛋白翻译抑制TGEV复制;除了对病毒复制直接的抑制作用,PERK-eIF2α通路还激活NF-κB,促进I型干扰素产生,从而抑制TGEV复制。该研究表明内质网应激的PERK-eIF2α通路在调节天然免疫和冠状病毒复制方面发挥重要作用。
本研究是在国家重点研发计划(2016YFD0500100和2017YFD0502200)的资助下完成的。薛美博士为本文第一作者,冯力研究员和刘平黄研究员为共同通讯作者。(薛美 刘平黄)
论文链接:jvi.asm.org/content/early/2018/05/10/JVI.00431-18.full.pdf